Medische verhalen
Atriumfibrilleren (oktober 2012)

Dé ritmestoornis van de 21e eeuw
Dr. Natasja de Groot, cardioloog/elektrofysioloog, Erasmus Medisch Centrum, Rotterdam
Ook ICD-dragers, krijgen vaak te maken met atrium- of boezemfibrilleren. Daarom heeft de redactie er in de loop der jaren regelmatig aandacht aan besteed maar vaak betrof dat slechts één of twee aspecten van de ziekte. Daarom stellen wij het erg op prijs dat dr. Natasja de Groot bereid was voor het STIN-Journaal een artikel te schrijven waarin zij op begrijpelijke wijze en aan de hand van duidelijke illustraties uiteenzet hoe boezemfibrilleren ontstaat, wat de symptomen zijn, hoe de diagnose gesteld wordt en hoe het behandeld kan worden.
Het normale hartritme
Het hart is een holle spier die bestaat uit twee helften, gescheiden door een tussenschot van hartspierweefsel. Elke harthelft bestaat uit een kamer en een boezem. Het normale hartritme ontstaat in de sinusknoop (Figuur 1A). De sinusknoop bevindt zich in de wand van de rechterboezem, op de overgang naar de bovenste holle ader. De sinusknoop bestaat uit een groep gespecialiseerde cellen die spontaan elektrische prikkels aan de hartspier afgeeft. Vanuit de sinusknoop ontstaat één groot elektrisch golffront dat zich verspreidt over beide boezems waardoor deze samentrekken. Via een tweede groep gespecialiseerde cellen (atrio-ventriculaire knoop) gelegen tussen de boezem en de kamer wordt het elektrische golffront naar de hartkamers geleid waardoor deze samentrekken en het bloed het lichaam wordt ingepompt. Het samentrekken van de hartkamers wordt gevoeld als een hartslag. Het sinusritme heeft een frequentie tussen de 60 en 100 slagen per minuut.
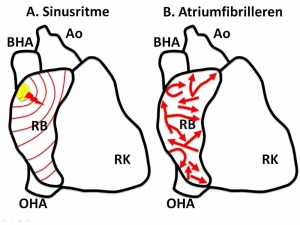
Figuur 1A. De elektrische activatie van het hart ontstaat in de sinusknoop
(gele rondjes). Vanuit de sinusknoop verspreidt zich een groot elektrisch
golffront over de boezem (rode lijnen) richting de hartkamers.
Figuur 1B. Tijdens boezemfibrilleren zijn er meerdere elektrische golf-
fronten (rode pijlen)die in diverse richtingen lopen. Golven splitsen,
fuseren en doven weer uit waardoor het activatiepatroon een chaos is.
RB = rechterboezem, RK = rechterkamer, OHA = onderste holle ader,
BHO = bovenste holle ader, AO = aorta.
Atriumfibrilleren
Atriumfibrilleren, ook wel boezemfibrilleren genoemd, is een hartritmestoornis die ontstaat in de boezems van het hart en is de meest voorkomende hartritmestoornis. Op dit moment heeft in Nederland vijftien procent van de mensen die ouder zijn dan 65 jaar atriumfibrilleren. De verwachting is dat het aantal patiënten met atriumfibrillerenin de komende eeuw explosief zal toenemen door onder andere vergrijzing van de bevolking. Atriumfibrilleren betekent letterlijk 'trillen van de hartboezem' en ontstaat in de twee boezems van het hart (boezems = atria). Deze hartritmestoornis zien we vaker bij mensen met een hoge bloeddruk, suikerziekte, overgewicht, hartklepafwijkingen en een gestoorde schildklierfunctie.
Tijdens atriumfibrilleren worden de boezems geactiveerd door vele - dit kunnen er bijvoorbeeld zestien op vier cm2 zijn - smalle elektrische golven die dwars door elkaar heen lopen (Figuur 1B). Deze golven botsen tegen elkaar, draaien om elkaar heen en doven weer uit. De boezems worden met hoge frequenties geactiveerd. Dit kan oplopen totmeer dan 300 slagen per minuut! Het belangrijkste kenmerk van atriumfibrilleren is dat de elektrische golven continu een ander pad nemen waardoor de boezems elke hartslag anders geactiveerd worden.
Ten gevolge van het chaotische activatiepatroon wordt de atrio-ventriculaire knoopalleen geactiveerd door elektrische golven die ‘toevallig’ deze knoop bereiken. De tijd tussen opeenvolgende golven die de atrio-ventriculaire knoopactiveren is onregelmatig, waardoor de hartkamers onregelmatig samentrekken. Dit kan heel snel zijn, maar soms ook heel langzaam. Gelukkig beschermt de atrio-ventriculaire knoopde kamers tegen hoge hartfrequenties doordat niet alle elektrische impulsen aan de kamers worden doorgegeven.Het onregelmatige kamerritme dat hier het gevolg van is kan aanleiding geven tot hartkloppingen.
De precieze ontstaanswijze van boezemfibrilleren is tot op heden onbekend waardoor de behandeling van atriumfibrilleren moeizaam kan zijn.
Symptomen
Veel mensen met atriumfibrilleren ervaren hartkloppingen die onregelmatig en meestal snel zijn. Door de hoge hartfrequenties kan er een zuurstoftekort van de hartspier ontstaan, waardoor de patiënt pijn op de borst krijgt.
Als de hartslag heel traag is doordat de atrio-ventriculaire knoop minder snel geleidt (bijvoorbeeld bij oudere patiënten) wordt de hartslag juist heel traag wat aanleiding kan geven tot duizeligheid en neiging tot flauwvallen.
Als het hart langdurig op hoge frequenties wordt geactiveerd, raken de hartspiercellen beschadigd waardoor de pompfunctie van het hart achteruit gaat. Hierdoor kan hartfalen ontstaan. Patiënten worden kortademig doordat vocht zich ophoopt in de longen en raken sneller vermoeid omdat er minder bloed in de spieren wordt rondgepompt.
Doordat de vele golffrontjes slechts een heel klein deel van de boezems activeren (oppervlakte van enkele millimeters), trekken de boezems niet meer als één geheel samen. Hierdoor stroomt het bloed niet goed meer door en ontstaan er bloedstolsels. Als deze bloedstolsels door het hart uitgepompt worden, verstoppen zij meestal de bloedvaten die naar de hersenen lopen en ontstaat er een beroerte. Helaas is bij sommige mensen een beroerte het eerste symptoom van atriumfibrilleren.
Atriumfibrilleren kan echter ook geheel zonder klachten aanwezig zijn (‘asymptomatisch’) en wordt dan bij bijvoorbeeld een bedrijfskeuring ontdekt.
Atriumfibrilleren: de diagnose
Atriumfibrilleren kan aanvalsgewijs (‘paroxysmaal’) of continu (‘persistent/permanent’) aanwezig zijn. De diagnose wordt meestal gesteld met behulp van een elektrocardiogram (hartfilmpje). Als atriumfibrilleren alleen in kortdurende aanvallen voorkomt, is het moeilijker de diagnose vast te stellen. Er wordt dan een Holter monitor meegegeven; een klein kastje dat het hartritme 24-48 uur continu registreert. Als de aanvallen heel weinig voorkomen, kan er ook een ‘implantable loop recorder’ geïmplanteerd worden; een soort usb-stickje dat onder de huid bij het hart geplaatst wordt. Deze recorder registreert het hartritme gedurende twee jaar.
Behandeling van atriumfibrilleren: herstel van het sinusritme
Uit onderzoek is gebleken dat episodes atriumfibrilleren in de loop van de tijd steeds vaker ontstaan en langer duren totdat het uiteindelijk niet meer vanzelf stopt. Het atriumfibrilleren is dan overgegaan van het paroxysmale naar het persistente type. Indien het normale sinusritme niet meer hersteld kan worden, is er sprake van permanent atriumfibrilleren.
Cardioversie
Als het atriumfibrilleren niet meer vanzelf stopt en continu aanwezig is, kan het normale hartritme hersteld worden door middel van een stroomstoot (elektrische cardioversie, Figuur 2). Dit gebeurt uiteraard nadat de patiënt in slaap is gebracht. Het ritme kan ook hersteld worden door een medicijn dat via een infuus wordt toegediend (chemische cardioversie). Hierbij blijft de patiënt wel wakker. Na een cardioversie moet de patiënt medicijnen gebruiken om te voorkomen dat er weer atriumfibrilleren ontstaat.
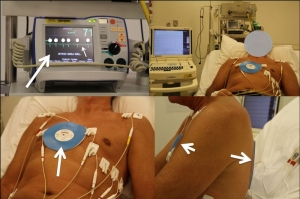
Elektrische cardioversie. In de linker bovenhoek staat het apparaat waarmee de shock wordt afgegeven (‘defibrillator’). Het scherm toont atriumfibrilleren (witte pijl), gekenmerkt door onregelmatige contracties van de hartkamer en kleine golfjes die de boezemactivatie weergeven.
Rechts boven ligt de patiënt klaar voor een cardioversie. Op zijn buik zit één grote blauwe plakker voor de cardioversie. De kleinere plakkers met de elektrodes zijn voor registratie van het hartfilmpje. De stroomstoot wordt afgegeven door twee blauwe plakkers, één op de buik (witte pijl) en de ander op de rug (links- en rechtsonder).
(Met dank aan E. Peters en de patiënt voor de foto’s.)
Medicijnen
Indien atriumfibrilleren aanvalsgewijs ontstaat, worden er medicijnen gegeven om te voorkomen dat er opnieuw ritmestoornissen ontstaan. Voorbeelden hiervan zijn sotalol en cordarone. Deze medicijnen kunnen bijwerkingen geven zoals vermoeidheid, koude handen en voeten, duizeligheid (sotalol), overgevoeligheid voor zonlicht en schildklierfunctie-stoornissen (cordarone).
Katheterablatie
De longaderen die het zuurstofrijke bloed vanuit de longen naar de linkerboezem voeren, spelen bij sommige patiënten een rol bij het ontstaan van atriumfibrilleren. In deze longaderen bevinden zich uitlopers van hartspierweefsel waarin cellen gelegen zijn die extra hartslagen kunnen maken. Deze salvo’s van extra hartslagen activeren de boezems met een hoge frequentie. Bepaalde delen van de boezems kunnen de hoge frequenties niet volgen en de geleiding wordt onregelmatig. De grote elektrische golffronten die vanuit de longaderen komen, splitsen op in diverse delen en er ontstaat atriumfibrilleren.
Katheterablatie is een invasieve behandeling waarbij hartspierweefsel vernietigd wordt. In het algemeen ondergaat de patiënt deze behandeling bij volledig bewustzijn. Allereerst worden de huid en het onderliggend weefsel rondom de bloedvaten in de benen verdoofd (Figuur 3). Daarna worden de bloedvaten aangeprikt met een holle naald waardoor een metalen draadje (‘guide wire’) wordt opgevoerd. De holle naald wordt vervolgens verwijderd en het draadje blijft in de lies zitten. Hierna wordt een plastic buisje (‘sheath’) over het metalen draadje geplaatst en kan het draadje verwijderd worden. Het plastic buisje geeft toegang tot het bloedvat dat naar het hart loopt (‘onderste holle ader’). Vervolgens wordt een dun slangetje met elektrodes aan de tip opgevoerd (‘katheter’). Deze elektrodes worden gebruikt om elektrische signalen in het hart te meten.
Door op meerdere plaatsen elektrische signalen te meten kan de elektrische geleiding in het hart in kaart worden gebracht (‘mapping’). Daarna wordt het hartspierweefsel waar de hartritmestoornis vandaan komt, vernietigd. Dit gebeurt door middel van verhitting (‘radiofrequente ablatie’) of door bevriezing van het weefsel (‘cryo-ablatie’). De katheterablatie van atriumfibrilleren heet ‘pulmonaal vene isolatie’. Hierbij worden de vier longaderen (‘pulmonaal venen’) die in de linkerboezem uitmonden geïsoleerd van de linkerboezem door rondom elke longader een litteken in de vorm van een cirkel te maken. Hierdoor kunnen extra slagen die in de longaderen ontstaan de linkerboezem niet meer bereiken en dus geen atriumfibrilleren meer veroorzaken. Deze behandeling is niet voor iedereen effectief; helaas blijkt dat bij sommige patiënten atriumfibrilleren toch weer terugkomt omdat het hartspierweefsel in de hele boezems elektrisch ziek is.
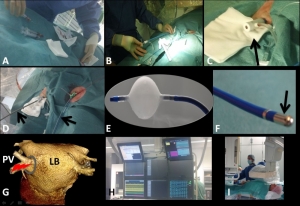
A. Aanprikken van de aderen in de liezen. B-C. Daarna wordt een plastic buisje (witte pijl) over een metalen draad in de lies gebracht. Het plastic buisje zit in het bloedvat (zwarte pijl). D. In het linker- en rechterbeen zijn buisjes ingebracht die dienen voor het opvoeren van katheters (zwarte pijl). E. Ballonkatheter waarmee het hartspierweefsel bevroren wordt. Let op de koude dampen die er vanaf komen! F. Kathetertip waarmee 'gebrand' wordt.De kathetertip bevat een elektrode die elektrische signalen meet (zwarte pijl). G. CT-scan van de linkerboezem (LB) en longaderen (pulmonaal venen, PV). Rondom een PV wordt een litteken in de vorm van een cirkel gemaakt waardoor elektrische impulsen vanuit een longader (rode bliksem) niet meer in de linkerboezem kunnen komen. H. Alle schermen waarop tijdens een ablatieprocedure informatie voor de cardioloog-elektrofysioloog staat. I. De behandelend arts voert de behandeling uit terwijl de patiënt wakker op de operatietafel ligt.
Behandeling van atriumfibrilleren: vertraging van het hartritme
Als het normale hartritme niet meer hersteld kan worden, kan het atriumfibrilleren behandeld worden door het hartritme te vertragen. Dit doen we bijvoorbeeld als cardioversies niet meer succesvol zijn of als het atriumfibrilleren al heel snel na een cardioversie terugkomt. Het hartritme wordt vertraagd door medicijnen te geven die de geleiding door de atrio-ventriculaire knoop vertragen. De elektrische geleiding in de boezems is dan nog snel, maar de hartkamers, die de hartslag bepalen, trekken langzamer samen. Medicijnen hiervoor zijn bètablokkers en digoxine. Digoxine is echter niet effectief bij mensen die actief zijn.
Lukt het vertragen van de hartfrequentie met medicijnen niet, dan kan een zogenaamde Hisbundel-ablatie verricht worden. Hierbij wordt de elektrische verbinding tussen de boezems en kamers verbroken. In de boezems blijft het boezemfibrilleren dan wel bestaan. Omdat de elektrische golven de hartkamers niet meer bereiken, trekken de kamers niet meer samen waardoor het bloed niet meer in het lichaam wordt rondgepompt en heb je in feite een hartstilstand. Daarom moet, voordat de verbinding tussen boezems en kamers wordt doorgenomen, een pacemaker geïmplanteerd worden die elektrische pulsen aan de kamer afgeeft zodat er ook in de hartkamers een ritme is waardoor de kamers blijven samentrekken.
Leven met atriumfibrilleren
Als atriumfibrilleren is ontstaan, moeten de factoren die het ontstaan daarvan kunnen bevorderen, zoveel mogelijk bestreden worden. Te hoge bloeddruk bijvoorbeeld moet behandeld worden met bloeddrukverlagende medicijnen; overgewicht betekent afvallen en bij suikerziekte moeten de suikerwaardes stabiel zijn.
Zodra een episode atriumfibrilleren ontstaat, moet deze zo snel mogelijk beëindigd worden omdat de kans op herstel van het normale hartritme kleiner is naarmate een episode langer duurt. Treedt atriumfibrilleren op, dan loopt de patiënt het risico op het ontstaan van bloedstolsels met alle gevolgen vandien.Een belangrijk onderdeel van de behandeling van atriumfibrilleren is daarom het voorschrijven van bloedverdunners. Er zijn twee soorten bloedverdunners, aspirine en de ‘orale anti-stollingsmiddelen’ zoals marcoumar en sintrom waarvoor regelmatige controle door een trombosedienst nodig is.
Op dit moment zijn er ook enkele anti-stollingsmiddelen beschikbaar waarvan elke dag een vaste dosering ingenomen moet worden zoals xarelto en pradaxa. Controle door een trombosedienst is bij het gebruik van deze medicijnen niet meer nodig. Anti-stolling vermindert de kans op een herseninfarct van 4.5% naar 1.5% per jaar!
Onderzoek
Om de behandeling van atriumfibrilleren in de toekomst te verbeteren, doen wij in het Erasmus MC vernieuwend onderzoek naar de elektrische geleiding in het hart. Om te begrijpen waardoor de elektrische geleiding tijdens atriumfibrilleren verstoord raakt, moeten wij eerst de normale geleiding in het hart in detail onderzoeken.
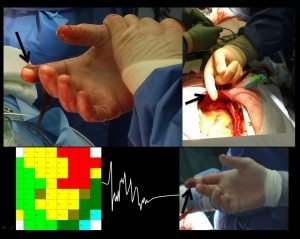
Innovatief onderzoek naar het mechanisme van atriumfibrilleren in het Erasmus MC door dr. N. de Groot en promovenda drs. A. Yaksh in samenwerking met hartchirurg dr. C. Kik. Aan de vinger van de chirurg wordt een kleine elektrode geplaatst die aan de buitenzijde van het hart wordt geplaatst tijdens een open hartoperatie (zwarte pijlen). Deze elektrode registreert op meerdere plaatsen elektrische signalen waardoor ‘routekaartjes’ van de elektrische golven worden gemaakt. In het onderste panel wordt in het midden een voorbeeld van een elektrisch signaal getoond. Links staat een kleurgecodeerde activatiemap (routekaartje); de golf loopt van rood, geel, rood, oker, groen naar lichtblauw.
Bij een groot aantal patiënten die een hartoperatie ondergaan wordt er daarom tijdens de operatie een plastic plaatje (dit is de elektrode) ter grootte van de tip van een vinger op de buitenzijde van het hart gehouden ter hoogte van de boezem. Deze elektrode meet op één cm2 wel 60 elektrische signalen tegelijkertijd (Figuur 4). De chirurg schuift zijn vinger over de oppervlakte van beide boezems. Op elke plaats worden 60 elektrische signalen opgevangen en vastgelegd. Vervolgens worden van deze elektrische signalen na de operatie ‘routekaartjes’ van de elektrische golven gemaakt. Door het hartritme op deze wijze te visualiseren, kan de elektrische geleiding in detail worden vastgelegd. Zo wordt onderzocht of de routekaartjes van mensen mét en zónder deze hartritmestoornis verschillen.
Tot slot
Kortom, patiënten met atriumfibrilleren vormen een grote groep mensen met een variatie in aandoeningen en klachtenpatroon. Tevens verschillen de episodes van het atriumfibrilleren in frequentie, duur en opstartpatroon. Om de behandeling van deze ritmestoornis in de toekomst te verbeteren, is onderzoek naar het mechanisme van deze ritmestoornis essentieel
Lees meer
- Nederlandse Hart Registratie van start
- Radiotherapie bij patiênten met een ICD
- 'Innoveren voor best mogelijke zorg'
- Cryo-ablatie succesvol bij boezemfibrilleren
- 'Hart 3.0 betreft regeneratie van de hartspier'
- 'ICD-controle dichtbij is patiëntvriendelijk'
- Hartspierziekte door eeuwenoud Fries foutje
- Impact van ICD bij maken van mammogram (okt. 2015)
- Specifieke problemen met ICD's bij kinderen
- Nieuwe antistollingsmiddelen
- Betere medicijnen voor antistolling verwacht
- Hartfunctie verbetert: ICD is niet meer nodig (apr
- Pacemakerbehandeling kan effectiever
- Wel of geen defibrillatietest tijdens ICD-implanta
- Medicijngebruik Brugada
- ICD steeds vaker MRI-bestendig (oktober 2014)
- Professor Pedro Brugada (juli 2014)
- Ablatietechniek uit de VS toegepast (april 2014)
- Complicaties bij implantaties (april 2014)
- Wat vinden ICD-dragers van remote monitoring?
- Een draadje in of op het hart. Wat is het verschil
- Verlaging van stralingswaarde tijdens ablaties een
- Stamceltherapie biedt mogelijk voedingsbodem voor
- De cardioloog-elektrofysioloog.
- Nieuwe antistollingsmiddelen. Het voor en tegen
- Cardiale contractiliteit modulatie
- Eerste draadloze pacemakers geïmplanteerd
- Cardiogenetica, een wetenschap in ontwikkeling
- De neurostimulator: een nieuwe behandeling voor pa
- Hart in drie dimensies (januari 2013)
- Atriumfibrilleren (oktober 2012)
- Met pacemaker of ICD in de MRI (oktober 2012)
- ICD’s en het risico op infecties (oktober 2012)
- Specialist in ontregelde ritmes (oktober 2012)
- Richtlijn Radiotherapie bij patiënten met een ICD
- Verschillen tussen vrouwen en mannen met een ICD?
- Uitbreiding indicatie bivent. pacemakers en ICD's
- Vervanging ICD niet altijd vanzelfsprekend. Een voorstel (april 2012)
- Goed nieuws over hart- en vaatziekten. Ontwikkelingen in diagnose en behandeling (april 2012)
- Primaire preventie tegen plotse hartdood met een ICD: heeft de oudere patiënt hier net zoveel voordeel van als de jongere? (januari 2012)
- MRI-scan in veel gevallen veilig voor pacemaker- en ICD-dragers (januari 2012)
- Strenge normen voor ziekenhuis dat ICD-implantaties uitvoert (oktober 2011)
- Hartfalen bij vrouwen (oktober 2011)
- Het steunhart als permanente behandeling van chronisch hartfalen: een nieuw tijdperk is aangebroken ( april 2011)
- Bewaking op afstand kan gemoedsrust bieden aan patiënten met recall-ICD draden (april 2011)
- ICD-implantaties bij kinderen (april 2011)
- Studie concludeert: In Amerika worden veel ICD's onterecht geïmplanteerd (april 2011)
- Bij wie hapert het hart? (januari 2011)
- STIN en telecardiologie - een standpunt-bepaling vanuit het perspectief van de ICD-drager (januari 2011)
- Is primaire preventie door implanteerbare cardioverter defibrillatoren "shockproof" of zinvol? (oktober 2010)
- De toenemende rol van telecardiologie bij de behandeling van hartziekten en de gevolgen daarvan voor behandelaar en patiënt (april 2010)
- Hartritmestoornissen? Trek een defibrillator aan! (januari 2010)
- Maatwerk in het VU medisch centrum. Individueel maatwerk voor patiënten met hartfalen en Cardiale Resynchronisatie Therapie (januari 2010)
- Erfelijkheidsonderzoek naar oorzaak van plotse hartdood (juli 2009)
- Beëindigen van ICD-therapie: een optie? (januari 2009)
- De geheimtaal van het elektrocardiogram (januari 2009)
- De NYHA-classificatie (oktober 2008)
- Kastje voor kinderhart (oktober 2008)
- Orde in de chaos, deel 1: Boezemritmestoornissen (mei 2008)
- Orde in de chaos, deel 2: Kamerritmestoornissen (mei 2008)
- Erfelijkheidsonderzoek en de gevolgen voor ICD-indicaties (oktober 2007)
- Bevolkingsonderzoek naar borstkanker bij ICD-draagsters (oktober 2007)
- Waarom sterven jonge sporters plots aan een hartstilstand? (oktober 2007)
- ICD-implantaties bij kinderen (april 2007)
- Vraagtekens bij de veiligheid van de implanteerbare cardioverter en defibrillator: de recall procedures (januari 2007)
- Hartritmestoornissen bij duursporters (november 2006)
- ICD-draagster en zwangerschap (juli 2006)
- Wij waren ICD-draagster tijdens onze zwangerschap (Redactie juli 2006)
- Stilstaan door hyperactiviteit (januari 2006)
- De implanteerbare cardioverter en defibrillator: van alleen een shock naar volledig therapieplatform: de toekomst (juli 2005)
- De ICD: Levensredder bij uitstek (november 2004)
- Implantatie van de ICD: onder narcose of met plaatselijke verdoving (juli 2003)